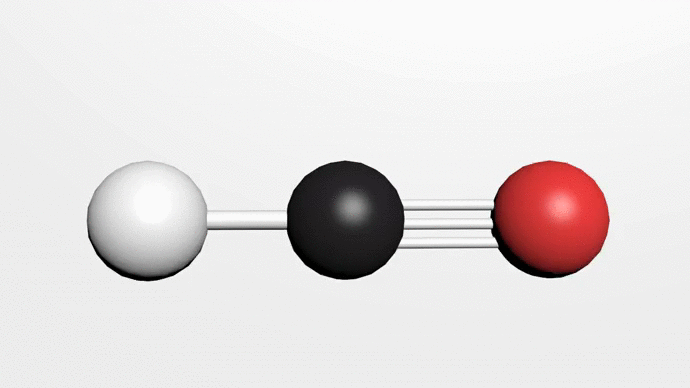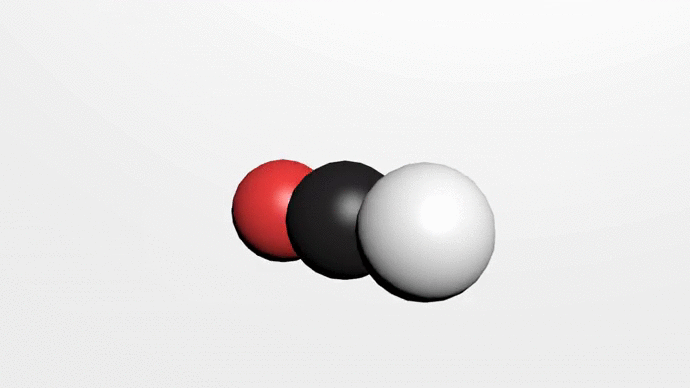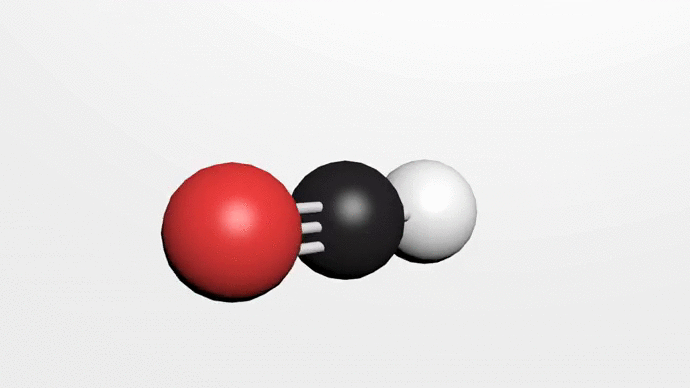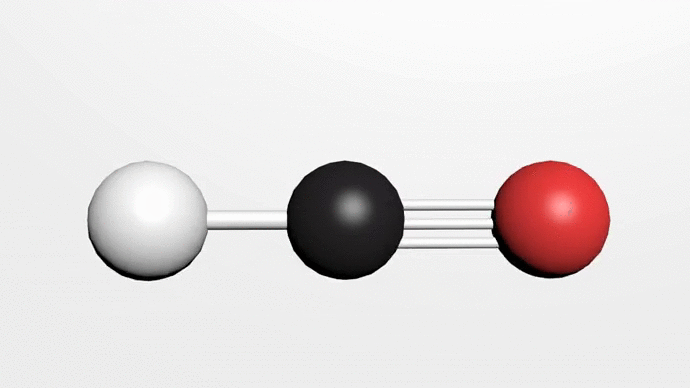Karbidy jsou binární sloučeniny uhlíku s elektropozitivnějšími prvky. Nejčastěji se připravují reakcí uhlíku s kovy nebo jejich oxidy při vysokých teplotách. Některé z nich lze také připravit reakcí zahřátého kovu s uhlovodíky. Podle struk-tury se karbidy dělí na iontové, intersticiální, prvků skupiny železa a kovalentní.
a) Iontové karbidy lze považovat za soli acetylenu', protože atomy vodíku vázané v jeho molekule jsou mírně kyselé a lze je nahradit elektropozitivním kovem. Vznikající soli se nazývají acetylidy ave své struktuře obsahují acetylidové ionty Mezi iontové karbidy patří především acetylidy alkalických kovů a acetylicly kovů alkalických zemin. Acetylidy alkalických kovů M2C2 (např. Na2C2) se nejčastěji připravují reakcí acetylenu s roztokem alkalického kovu v kapalném amoniaku.
Acetylidy kovů alkalických zemin MC2 (např. CaC2) lze připravit zahříváním příslušného kovu s acetylenem na teplotu vyšší než 500 °C, můžeme je však také získat reakcí daného kovu nebo jeho oxidu s uhlíkem. Acetylidy reagují s vodou za vývoje acetylenu. Jako příklad si uvedeme acetylid neboli karbid vápenatý CaC2, který se vyrábí reakcí oxidu vápenatého s koksem v elektrické peci.
Ca0 + 3C —s CaC2 + CO
Reakce karbidu vápenatého s vodou se dříve využívala 01,6- myslové výrobě acetylenu:
CaC2 + 2H20 ---> C2H2 + Ca(OH)2
V současné době se karbid vápenatý používá především jako surovina pro výrobu kyanamidu vápenatého CaCN2, který je významným průmyslovým hnojivem.
K iontovým karbidům se také řadí acetylid stříbrný, acetylid měďný a acetylid zlatný, které se však vodou nerozkládají.
 Vazebné v jejich molekulách mají interakce převážně kovalentní charakter všechny uvedené sloučeniny výbušné. ha intersticiální karbidy mají atomy uhlíku umístěny v mezerách 1') krystalových mřížek kovů. Poloměr kovového atomu však nesmí byt 17enší než 135 pm. Tuto podmínku Splňují např. Ti, Zr, V, Mo a W.
Vazebné v jejich molekulách mají interakce převážně kovalentní charakter všechny uvedené sloučeniny výbušné. ha intersticiální karbidy mají atomy uhlíku umístěny v mezerách 1') krystalových mřížek kovů. Poloměr kovového atomu však nesmí byt 17enší než 135 pm. Tuto podmínku Splňují např. Ti, Zr, V, Mo a W.
K iontovým karbidům se také řadí acetylid stříbrný, acetylid měďný a acetylid zlatný, které se však vodou nerozkládají.
Karbid v pevném skupenství

b) Intersticiální karbidy jsou žáruvzdorně, extrémně tvrdé a zachovávají si některé charakteristické vlastnosti kovů (lesk, vodivost). Jako příklad si uvedeme TaC a WC, které se používají k výrobě rychlořezných nástrojů.
Tantalum carbide

c) Karbidy prvků skupiny železa — Cr3C2, Mn3C, Fe3C, Co3C a Ni 1C —lze považovat za určitý přechod mezi iontovými a intersticiálními karbidy.
Jsou tvořeny kovy, jejichž atomové poloměry jsou příliš malé, a proto nesplňují podmínku pro vznik intersticiálních karbidů. Ve struktuře těchto látek se vyskytují řetězce tvořené uhlíkovými atomy. S vodou a zředěnými kyselinami reagují za vzniku uhlovodíků a vodíku.
Jsou tvořeny kovy, jejichž atomové poloměry jsou příliš malé, a proto nesplňují podmínku pro vznik intersticiálních karbidů. Ve struktuře těchto látek se vyskytují řetězce tvořené uhlíkovými atomy. S vodou a zředěnými kyselinami reagují za vzniku uhlovodíků a vodíku.
d) Kovalentní karbidy — Be2C, A14C3SiC a B4C — tvoří trojrozměrné atomové mřížky. Lze je připravit reakcí prvku nebo jeho oxidu s uhlíkem. První dva — Be2C, A14C3 — reagují s vodou za vzniku methanu, zbývající dva — SiC a B4C — jsou chemicky značně odolné a mimořádně tvrdé.
Poslední významnou sloučeninou uhlíku, o které se zmíníme, je kyanovodík. Kyanovodík HCN je bezbarvá kapalina s bodem varu 25,6 °C. Tvoří lineární molekuly 1-1—C .N a bez Přítomnosti stabilizátoru polymeruje. Vyrábí se reakcí methanu s amoniakem při teplotách nad 1200 °C.
Na obrázku chemické složení Kyanovodíku
Reakci je třeba katalyzovat platinou. CH4 + NH3 ---> HCN + 3112 se Kyanovodík je výborným rozpouštědlem elektrolytii a sám jak velmi dobře rozpouští ve vodě. Jeho vodný roztok se chová jako velmi slabá kyselina. Je prudce jedovatý protože způsobuje k) 'n.-!lutí dýchacího centra nervové soustavy. Kyanovodík je důležitou surovinou pro výrobu kyanidu , nebo NaCN, kyanidu draselného KCN, methylmetakrylétu acetonitrilu.